柑皮症(かんぴしょう)とは、β-クリプトキサンチンやβ-カロテンなどのカロテノイド色素を摂り過ぎることにより手や顔の皮膚が黄色くなる症状をいいます。病気ではないので、自然に元に戻ります。皮膚がみかんの皮のような色になるから柑皮症という名称が付いているのでしょう。
柑皮症の原因は、分子構造的な側面から見てみるとβ-カロテンが水に溶けにくい性質(疎水性)、逆に言うと油に溶けやすい性質(親油性)だからです。脂溶性なので、β-カロテンを含む野菜の料理は油を使った料理の方が摂取効率が高いと言われています。もし、ビタミンCのように水溶性であったら尿で排泄されるでしょう。
それでは、有機化合物が水に溶ける、溶けないというのは構造式のみから判断できるのでしょうか。答えは、ある程度は予測可能です。実際に水に溶けなくても、親水性の相対的な比較はできます。
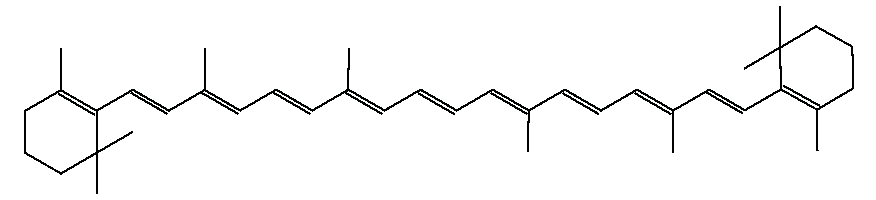
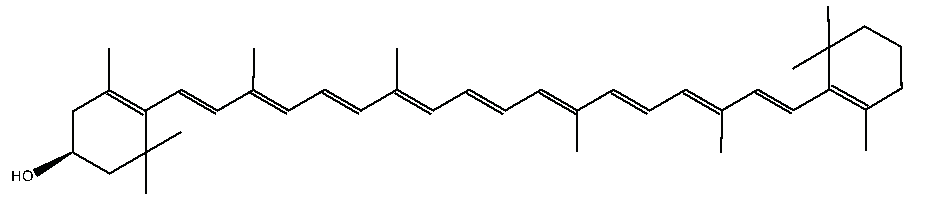
例えば、β-カロテン、β-クリプトキサンチン、ルテインはいずれも水に溶けません。しかし、相対的に最も親水性が高いのはルテインで、次がβ-クリプトキサンチンで、最下位がβ-カロテンです。
β-カロテン
β-クリプトキサンチン
ルテイン
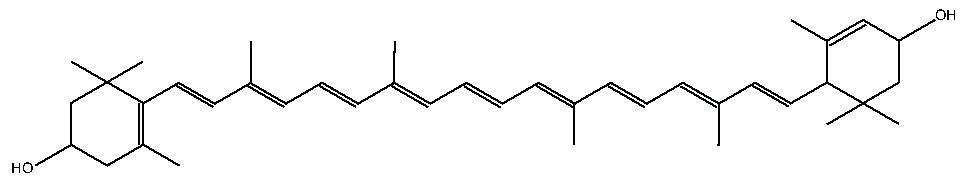
その理由は、親水基である水酸基(-OH)がβ-カロテンには0個、β-クリプトキサンチンには1個、ルテインには2個付いているからです。でも、水酸基以外の部分が著しく疎水性(親油性)が高いので、水には溶けません。水酸基の親水性はさほど大きくはないので、低級アルコールCnH2n+1OHで考えたら(この場合の低級は品質が低いという意味ではなく、炭素数が少ないという意味です)、n=1のメタノールCH3OH、n=2のエタノールC2H5OH、n=3のプロパノールC3H7OHまでは水と混ざりますが、n=4のブタノールC4H9OH以上のアルコールでは、水と混ざりません(2層に分かれて水が下になります)。つまり、水酸基が1個では炭素数4個のブチル基をもはや水に溶かすことができなくなります。よって、β-カロテンのような大きな疎水性の有機化合物に水酸基が1個、2個付いたぐらいでは水には溶けません。もっと強力な親水基が必要になります。
たとえば皆さんがよく知っている石鹸です。ラウリン酸C11H23COOH、ミリスチン酸C13H27COOH、パルミチン酸C15H31COOH、ステアリン酸C17H35COOHを強アルカリで中和した金属塩の混合物です。やし油、パーム油、牛脂などを水酸化ナトリウムNaOHや水酸化カリウムKOHで加水分解(鹸化)して作るから混合物になります。つまり、元の油脂(トリグリセリド)の3本の長鎖アルキル基が上記脂肪酸のランダムな組み合わせでグリセリンにエステル結合で繋がっているからです。よって、強アルカリで鹸化すると単一物質ではなく混合物の脂肪酸の塩ができます。
例えばNaOHで鹸化した場合はラウリン酸ナトリウムC11H23COO–Na+、ミリスチン酸ナトリウムC13H27COO–Na+、パルミチン酸ナトリウムC15H31COO–Na+、ステアリン酸ナトリウムC17H35COO–Na+の混合物となります。これらは水に溶けます。その理由は、カルボン酸のナトリウム塩(R-COO–Na+)がアルコール性水酸基(R-OH)に比べてかなり親水性が高いからです。ステアリルアルコールC18H37OHがほとんど水に溶けないのに、ステアリン酸ナトリウムは水に溶けます。-COO–Na+が炭素数17のアルキル基を引き連れて水分子の水素結合ネットワークに潜り込むことができるわけですから、その親水性の高さがわかります。
もし、上記のルテインのアルコール性水酸基2個のかわりにカルボン酸ナトリウム-COO–Na+が2個付いていたら、高いpHの水溶液中だったらもしかしたら水に溶けるかもしれません。しかし、一般的に水溶性の色素でカルボン酸ナトリウムを親水基に持つものは少ないので、例えばスルホン酸ナトリウム(-SO3–Na+)のような強酸と強アルカリの中和でできた塩であれば、強力な親水基なので中性付近のpHでも水に溶けるかもしれません。あるいはアセチルコリンが有しているようなトリメチルアンモニウム基(-CH2CH2N+(CH3)3Cl–)のような4級アンモニウム塩型の親水基でも溶けるかもしれません。実際に溶けるかどうかはやってみないとわかりません。でも、このような考え方自体は間違いではありません。
親水基とはどういうものか、親水性とはどういうことか
水分子H2OはHδ+-Oδ--Hδ+のように分極しています。δは整数の1とかではなくて、「ほんのちょっと」という意味です。定量的なものではありません。だからNa+Cl–の結晶のような強いイオン結合ではありません(NaClの結晶の融点はとても高いことからわかります)。でも、弱いながらも3次元のネットワークを形成しています。だから水より重いけど水素結合ができない硫化水素H2Sは常温で気体ですが、水H2Oは液体です。そして、沸点も100℃と高いです。この水分子どうしの弱い結合は水素結合と呼ばれます。水は水素結合で三次元ネットワークを形成しています。ここに水素結合を全く受け入れることができない炭化水素CnH2n+2あるいはそのアルキル基CnH2n+1-などは潜り込むことができません。これがいわゆる「水と油」の関係です。でも、分子全体からみた親水基の割合が大きければ親水基が水分子と水素結合できることで分子全体が水に潜り込むことができます。だから、メタノールCH3OH、エタノールCH3CH2OH、プロパノールCH3CH2CH2OHまでは水と混ざりますが、ブタノールCH3CH2CH2CH2OH以上の炭素数になると水と混ざらなくなります。
親水基の親水性は、そこにくっつくことができる水分子の数が多いほど強いと考えることができます。だから、親水基は陽イオンであったり、陰イオンであったり、イオンでなくても孤立電子対(ローンペア)をたくさん有するものから構成されています(例えば中性洗剤の疎水基はラウリル基(ドデシル基)C12H25-などで、親水基はポリオキシエチレン、すなわちポリエーテル(-CH2CH2O-)n)。酸素原子上の孤立電子対はδ-を帯びているのでHδ+-Oδ--Hδ+のδ+の部分を受け入れることができるからです。ラウリルアルコール(ドデシルアルコール)C12H25-OHは水に溶けませんが、ポリ(たくさん)になると水に溶けます。
水に溶ける、溶けないの考え方
こうして見て来ると、ある分子が水に溶けるかもしれない、溶けないかもしれないというのは何となくわかりませんか。実際はやってみないとわからないですが、ある程度はわかります。なぜ完全に予測できないかというと、結晶中の分子間力がかなり強いものがあって、分子と分子を引き離すのが非常に困難な場合があるからです。ベンゼン環などをたくさん持った化合物にそういったものが多いです。
なぜβ-カロテンは摂り過ぎると蓄積されるのか
ビタミンC(L-アスコルビン酸)は水によく溶けるので、摂り過ぎても余った分は尿と一緒に出てきます。
ビタミンC(L-アスコルビン酸)
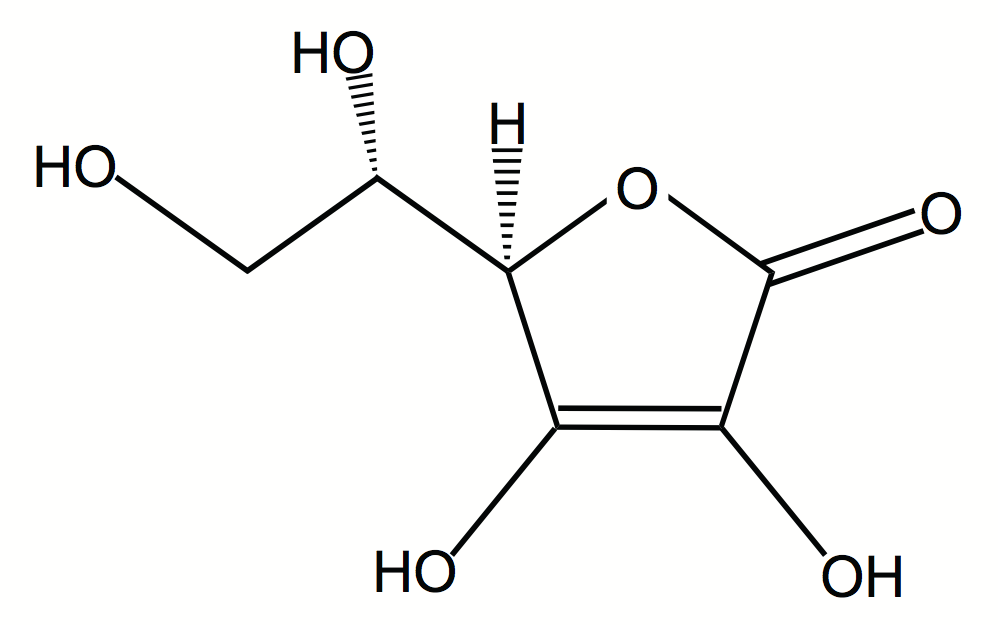
β-カロテンは尿と一緒には出てきません。体内での作用機序はさておき、有機化学の分子構造の観点からみた場合、β-カロテン分子が親油性(疎水性)が高く水に溶けないので体内の油の環境にとどまっていると理解できます。「水と油は混ざらない」けれども、「似たもの同士は混ざり合う」という考え方です。油と油は混ざり合うし、水と食塩Na+Cl–は混ざり合います(水に食塩Na+Cl–は溶けます)。油に食塩Na+Cl–は溶けません。
まとめ
以上、親水基、親水性の考え方を述べてみました。また、分子の親水性と疎水性のバランスで親水性の割合が大きければ水に溶ける可能性が高いという考え方を述べてきました。水素結合に関与できる有機化合物は、親水基の親水性がある程度強く、しかもたくさんあったりして、分子全体に占める親水性の割合がある程度大きければ、水に溶ける可能性が高いです。
みかんを食べ過ぎると肌が黄色くなるということは、ある意味、柑橘系を食べて実際に効果が有るということを奇しくも実感できます。